Los alcoholes son especies anfóteras (anfipróticas), pueden actuar como ácidos o bases. En disolución acuosa se establece un equilibrio entre el alcohol, el agua y sus bases conjugadas.
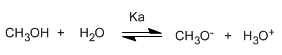
Escribiendo la constante del equilibrio (Ka)
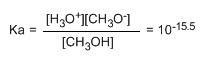
El pequeño valor de la constante nos indica que el equilibrio está totalmente desplazado a la izquierda. El logaritmo cambiado de signo de la constante de equilibrio nos da el pKa del metanol, parámetro que indica el grado de acidez de un compuesto orgánico.
pKa = - log ka = 15.5
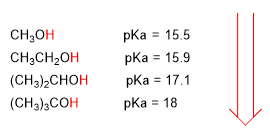
El aumento del pKa supone una disminución de la acidez. Asi, el metanol con un pka de 15.5 es ligeramente más ácido que el etanol con pka de 15.9.
El pKa de los alcoholes se ve influenciado por algunos factores como son el tamaño de la cadena carbonada y los grupos electronegativos
Al aumentar el tamaño de la cadena carbonada el alcohol se vuelve menos ácido.
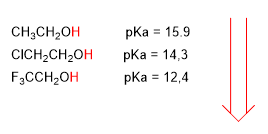
Los grupos electronegativos (halógenos) aumentan la acidez de los alcoholes (bajan el pKa)
FUENTE: Fernández (2008). Acidez y basicidad de alcoholes. México: Germán Fernández. (Recuperado el 4/11/12 de http://www.quimicaorganica.org/alcoholes/409-acidez-y-basicidad-de-alcoholes.html)
El alcohol es un magnifico compuesto, ya además de tener miles de aplicaciones, puede actuar como una base, pero a la vez como un ácido, lo que es muy extraño es que las bases neutralizan a los ácidos, es decir, les quitan esa propiedad de ácido, actualmente ninguna sustancia puede actuar como ambos (al menos que sea neutra), pero el alcohol si, lo cual lo hace ser aún más magnífico :O
ResponderEliminar